질소 산화물
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
질소 산화물(NOx)은 일산화 질소(NO)와 이산화 질소(NO₂)를 포함하며, 연소 과정에서 주로 발생한다. 다양한 형태의 질소 산화물이 존재하며, 번개나 토양 미생물에 의해 자연적으로 생성되기도 한다. 인위적으로는 물질의 연소 과정, 특히 고온·고압 조건에서 공기 중 질소와 산소의 반응 또는 연료 내 질소 화합물의 연소를 통해 발생한다. 질소 산화물은 광화학 스모그, 산성비, 미세먼지, 온실 효과, 오존층 파괴 등 심각한 환경 문제를 야기하며, 인체에도 유해하다. 이러한 문제를 해결하기 위해 저NOx 연소 기술, 배연 탈질 기술 등이 사용되며, 대한민국 정부는 자동차 배출가스 규제 강화, 친환경차 보급 확대, 산업 부문 배출 허용 기준 강화 등의 정책을 시행하고 있다.
더 읽어볼만한 페이지
- 질소 산화물 - 삼산화 이질소
삼산화 이질소는 질소 산화물 중 하나로 질소의 산화수가 +3인 화합물이며, 저온에서 일산화 질소와 이산화 질소를 혼합하여 얻을 수 있고, 액체 상태에서는 진한 청색을 띠며, 고온에서는 분해되고 물에 녹으면 아질산으로 가수분해되는 특징을 가진 평면형 구조의 화합물이다. - 질소 산화물 - 일산화 질소
일산화 질소는 조지프 프리스틀리에 의해 처음 확인된 무색 기체 화합물로, 혈관확장제로서 심혈관계에서 중요한 역할을 하며 생물학적 신호 전달 물질이자 대기오염의 원인이 되는 반응성이 큰 물질이다. - 무기 질소 화합물 - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다. - 무기 질소 화합물 - 삼산화 이질소
삼산화 이질소는 질소 산화물 중 하나로 질소의 산화수가 +3인 화합물이며, 저온에서 일산화 질소와 이산화 질소를 혼합하여 얻을 수 있고, 액체 상태에서는 진한 청색을 띠며, 고온에서는 분해되고 물에 녹으면 아질산으로 가수분해되는 특징을 가진 평면형 구조의 화합물이다. - 대기 오염 - 먼지
먼지는 0.001~1000μm 크기의 다양한 고체 입자로, 총먼지, 초미세먼지 등으로 나뉘며 무기, 유기, 혼합분진으로 분류되고, 발생원에 따라 건강과 환경에 다양한 영향을 미치며, 집먼지진드기, 우주 먼지 등도 포함된다. - 대기 오염 - 산성비
산성비는 화석 연료 연소 등으로 대기 중의 오염 물질이 황산, 질산으로 변하여 pH 5.6 미만의 산성을 띠는 비로, 생태계 파괴, 건축물 부식, 인체 유해 등의 피해를 유발하며, 기술적, 정책적 노력을 통해 해결하려 한다.
2. 종류 및 특성
질소 산화물은 질소와 산소의 화합물로, 다양한 종류가 존재한다. 이들은 서로 다른 화학적 특성과 반응성을 보인다.
- 일산화 질소(NO)
- 이산화 질소(NO₂)
- 삼산화 질소(NO₃)
- 아산화 질소(N₂O)
- 이산화이질소(N₂O₂)
- 삼산화이질소(N₂O₃)
- 사산화이질소(N₂O₄)
- 오산화이질소(N₂O₅)
- 아질산 아지드(N₄O)
- 니트릴 아지드(N₄O₂)
- 옥사테트라졸(N₄O)
- 트리니트라미드(N₄O₆)
이 외에도 다양한 음이온 및 양이온 형태의 질소 산화물이 존재한다.
대기 화학에서 NOx는 일산화 질소(NO)와 이산화 질소(NO₂)의 합을 나타내며[1][2], NOy는 NOx와 질산(HNO₃), 아질산(HNO₂) 등 산화된 대기 중의 모든 홀수 질소 종을 포함한다. NOz는 NOy에서 NOx를 뺀 값이다.
혼합 질소 산화물(MON)은 사산화 이질소/이산화 질소에 일산화 질소가 용해된 용액을 말한다.
2. 1. 중성 산화물
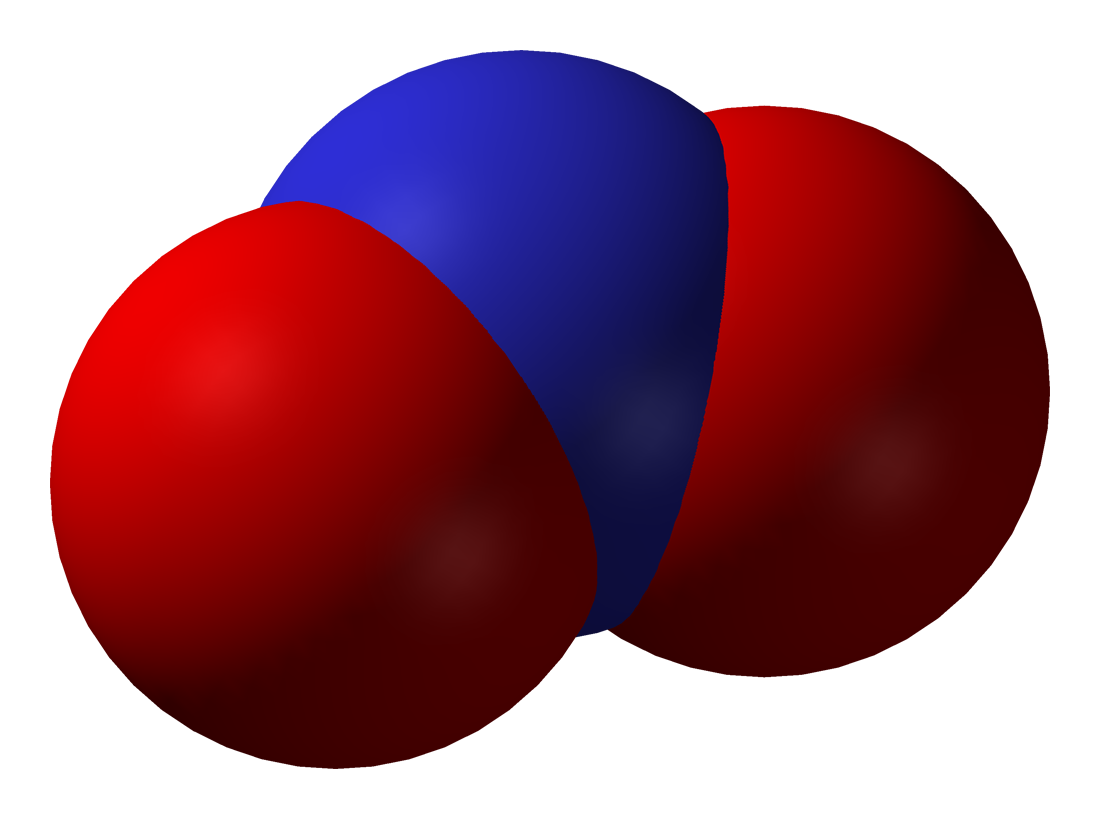
- 일산화 질소(NO): 무색, 무취의 기체로, 대기 중에서 산소와 반응하여 이산화 질소를 생성한다.[1][2]
- 이산화 질소(NO₂): 적갈색, 자극성 냄새의 유독성 기체로, 광화학 스모그와 산성비의 주요 원인 물질이다.[1][2]
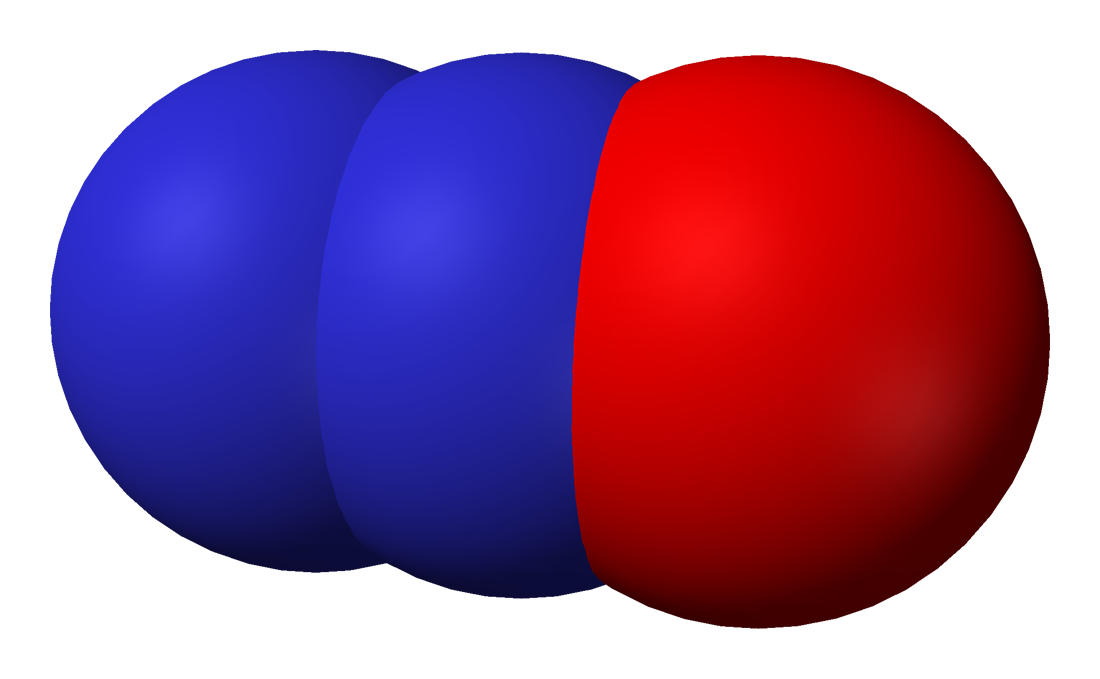
- 아산화 질소(N₂O): 무색, 달콤한 냄새의 기체로, 마취 작용이 있어 의료용으로 사용되며, 강력한 온실 기체이다.
- 삼산화 이질소(N₂O₃)
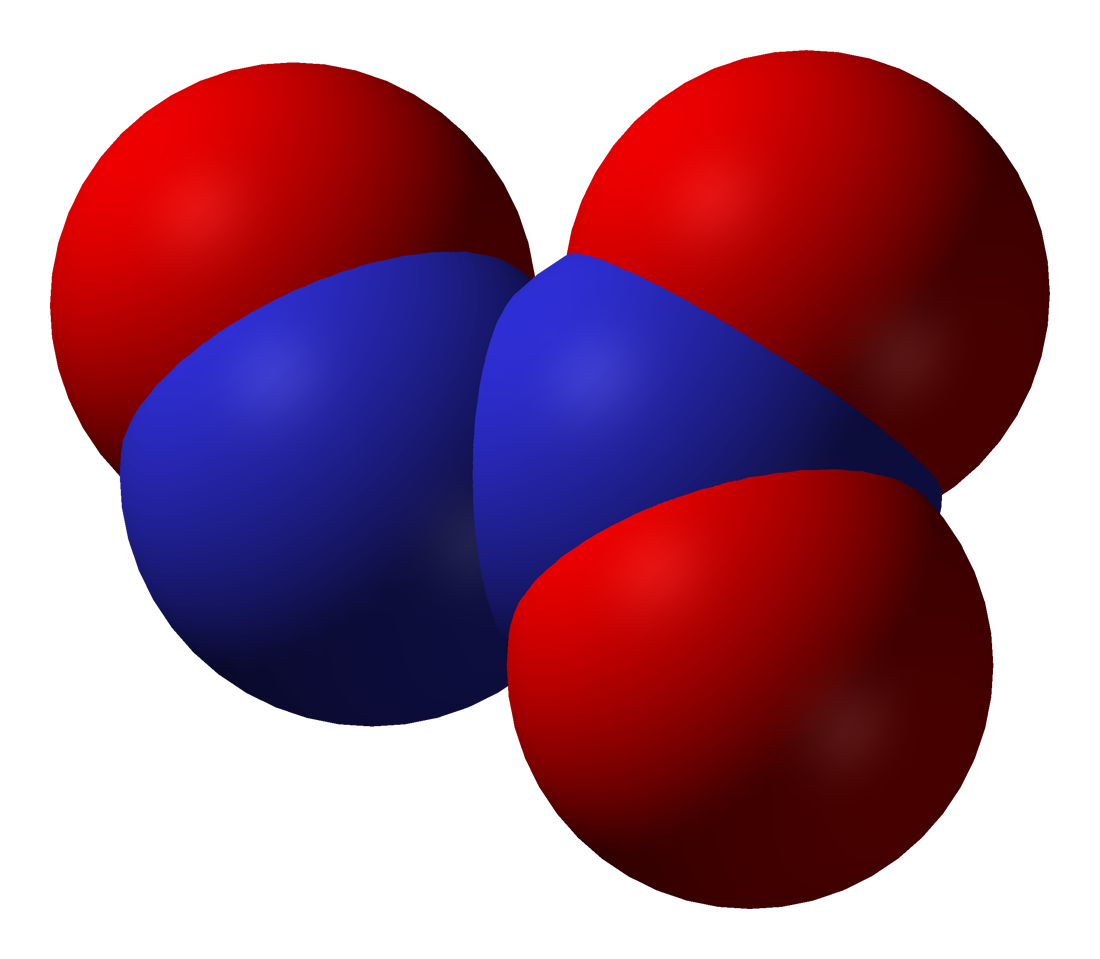
- 사산화 이질소(N₂O₄)
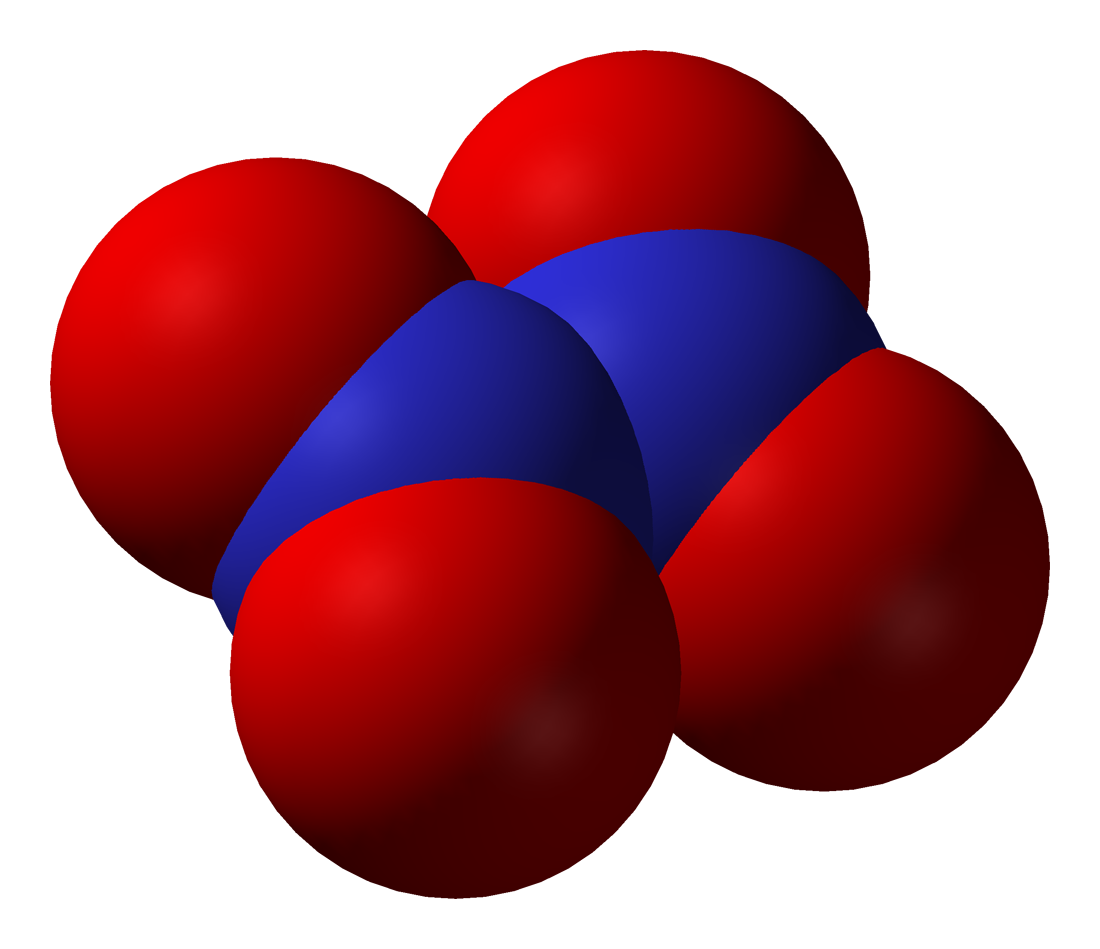
- 오산화 이질소(N₂O₅)
- 트리니트라미드(N₄O₆)

2. 2. 음이온
니트록사이드(NO⁻), 아질산염(NO₂⁻), 질산염(NO₃⁻) 등 다양한 음이온 형태의 질소 산화물이 존재한다.
2. 3. 양이온
- 니트로소늄 ()
- 니트로늄 ()
3. 생성
질소 산화물(NOx)은 일산화 질소와 이산화 질소(NO, NO2)를 함께 부르는 말이다. 질소 산화물은 자연적 요인과 인위적 요인으로 생성된다.[3] 1890년부터 1990년까지 100년 동안 대기에서 육상으로 침착하는 질소량은 5배 증가하여 21세기 초에는 125 Tg-N y-1(테라그램 질소 매년)로 추정되며, 방출량의 80%가 비료 기원이고 20%가 연소 기원이다.[3]
이산화 질소는 사산화 이질소와 평형 상태에 있으며, 환경 중 등 저압·저농도에서는 이산화질소 쪽으로 치우쳐 있다.
3. 1. 자연적 생성
자연계에서 질소산화물은 번개 또는 토양 속의 미생물에 의해 생성된다. 예를 들어 미생물이 많은 토양에 풍부한 화학비료를 주면 토양 미생물이 분해하여 질소산화물을 방출하는 사례가 알려져 있다.[3]3. 2. 인위적 생성
물질이 연소할 때 일산화 질소나 이산화 질소 등이 발생한다. 이 경우, 고온·고압에서 연소함으로써 원래 반응하기 어려운 공기 중의 질소와 산소가 반응하여 질소산화물이 되는 경우(서멀 NOx)와[3] 연료에 포함된 질소 화합물이 연소 과정에서 질소 산화물로 전환되는 경우(퓨얼 NOx)가 있다.[3] 예를 들어, 배기가스나 천연가스 보일러(가정용 조리 가스 기구 포함) 등에서 배출되는 질소산화물은 전자가 주이며, 석탄이 연소될 경우의 질소산화물은 대부분이 석탄 속의 질소 화합물에 기인하는 것으로 알려져 있다.[3]4. 인체에 대한 영향
질소 산화물(NOx)은 일산화 질소(NO)와 이산화 질소(NO2)를 함께 부르는 말이다. 질소 산화물을 흡입하면 메트헤모글로빈이 생성되는데, 이는 헤모글로빈의 철 이온이 산소 운반 능력을 상실한 형태이다.[4] 아산화 질소(N2O)는 마취 작용이 있어 의료 현장에서 흡입 마취제로 사용된다.
4. 1. 이산화 질소 (NO₂)
이산화 질소는 자체적으로는 중성이며 폐에서 흡수되기 쉬운 적갈색 기체 또는 액체이다. 세포 내에서는 이산화 질소가 강한 산화 작용을 나타내어 세포를 손상시키므로, 점막 자극, 기관지염, 폐부종 등의 원인이 된다.[4]4. 2. 일산화 질소 (NO)
일산화 질소(NO)는 1980년대부터 생체 내에서의 생리 기능에 대한 연구가 진행되어 혈관 확장 작용을 가지고 있다는 것 등이 밝혀졌을 뿐만 아니라, 신경전달물질로서도 작용하는 것이 판명되었다.[4] 1998년 노벨 생리학·의학상은 이 일산화질소의 생리 작용 발견에 대해 수여되었다. 현재도 그 다양한 생리 기능에 대한 연구가 계속되고 있다.일산화 질소를 흡입하면 메트헤모글로빈이 생성된다.[4] 메트헤모글로빈은 일반적인 헤모글로빈에 배위되어 있는 2가(페로)의 철 이온이 3가(페리)가 된 것으로, 산소를 운반할 수 없다.
4. 3. 아산화 질소 (N₂O)
아산화 질소(Nitrous oxide|나이트러스 옥사이드영어)는 마취 작용을 가지므로, 의료 현장에서 흡입 마취제로 사용되고 있다.[4]5. 환경 문제
질소 산화물(NOx)은 황산화물과 함께 산성비(산성강하물)와 미세먼지의 원인 물질이다.[3] 황산화물은 탈황 장치를 통해 액체 화석 연료에서 발생하는 것을 억제할 수 있지만, 연소 과정에서 생성되는 질소 산화물은 생성을 억제하기 어렵다. 생성된 질소 산화물은 강우나 안개(습성 침착) 및 미세먼지의 강하(건성 침착) 등을 통해 지표면에 침착되어 산림 생태계에 축적되며, 산림에 대한 축적량이 포화량을 초과하면 지표수의 질산이온 농도를 증가시킨다.[3]
5. 1. 대기 오염
질소 산화물은 광화학 스모그, 산성비, 미세먼지 등 대기오염의 주요 원인 물질이다.[3] 자동차와 같은 내연기관의 배기가스가 주요 발생원이며, 대한민국에서는 1992년 제정된 (2001년 개정) 자동차 배출가스 저감에 관한 특별법에 따라 규제를 받는다.[3] 특히 독성이 강한 이산화 질소(NO2)는 대기환경보전법에 따라 환경기준이 설정되어 있다.'''NO2의 환경기준''': 1시간 값의 1일 평균값이 0.04ppm~0.06ppm 이하.
5. 2. 지구 온난화
아산화질소(N2O)는 이산화탄소보다 310배 더 강력한 온실효과를 유발한다.[9]5. 3. 오존층 파괴
1970년대에 스웨덴의 크뤼첸(Crutzen) 박사가 성층권에서 질소 산화물(NOx)이 촉매 작용으로 오존 소멸 반응에 영향을 미친다는 것을 지적하여 오존층 과학에 발전을 가져왔다.[9] 2008년에는 아산화질소(N2O)가 가장 큰 오존층 파괴 물질이라는 것이 미국 연구팀에 의해 발표되었다.[10]6. 저감 기술 및 정책
질소 산화물(NOx) 저감 기술은 크게 저NOx 연소법과 배연 탈질법으로 나뉜다.[5]
6. 1. 저 NOx 연소 기술
저NOx 연소법에는 대기 중의 질소에 기인하는 서멀 NOx와, 연료 중에 포함된 질소 화합물에 기인하는 퓨얼 NOx가 있다. 이 중 서멀 NOx에 유효한 방법으로, 연소용 공기를 두 단계로 나누어 불어넣는 2단 연소법이 가스 연소에서 석탄 연소에 이르기까지 가장 넓은 범위에서 사용되고 있다.[5]서멀 NOx를 줄이려면 희박 연소로 연소 온도를 낮추는 것이 좋지만, 안정 연소 범위가 좁고 역화 등의 문제가 일어나기 쉽다. 이것을 방지하기 위해 파일럿 버너를 설치하거나, 버너의 개수로 출력을 조절하는 등의 방법이 필요하다.[6][7][8]
JR동일본 키하 E130계 기동차, JR시코쿠 1500형 기동차 등은 커먼 레일 방식의 연료 분사 장치를 사용한 디젤 엔진을 사용하여 배출량을 억제하고 있다.
6. 2. 배연 탈질 기술
배연 탈질법에는 습식법과 건식법이 있으며, 대형 연소 장치에서는 현재 건식법의 하나인 선택 촉매법이 주류를 이루고 있다. 연도부 앞에서 배기가스 중에 NH3를 불어넣고, 하류부에 설치된 촉매 반응기에서 NH3에 의한 NO의 선택적 환원을 실시한다.[5]요소 SCR 시스템에서는 암모니아원으로 안전하게 저장 가능한 요소를 사용하고 있다.
참조
[1]
법률
United States Clean Air Act
[2]
서적
Atmospheric Chemistry and Physics: From Air Pollution to Climate Change
https://archive.org/[...]
Wiley-Interscience
[3]
학술지
大気降下窒素が渓流水に流出する過程
[4]
학술지
アカタラセミアマウスに一酸化窒素,二酸化窒素曝露時のメトヘモグロビン生成
2018-11-04
[5]
학술지
酸性雨対策としてのSOx,NOx防除技術の最近の動向と将来展望
https://www.nies.go.[...]
[6]
웹사이트
JAXA|流体素子を用いた新しい低NOx燃焼方式の開発
https://www.jaxa.jp/[...]
2024-12-08
[7]
학술지
シンプル低 NO x 化技術
https://www.ihi.co.j[...]
[8]
학술지
お湯作りと燃焼
https://www.jstage.j[...]
[9]
학술지
オゾン層(創立125周年記念解説)
[10]
학술지
Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
